Nouveau programme AcSé : l'essai AcSé-FGFR
Mis à jour le
AcSé-FGFR est le second essai clinique lancé dans le cadre du nouveau programme AcSé, mis en place dans le cadre de la Stratégie décennale de lutte contre les cancers. Lancé en avril 2025, il est coordonné par Unicancer et financé par l’Institut national du cancer. Le traitement à l’étude est fourni par le laboratoire Incyte. Cet essai est en cours d’inclusion. Au 11 décembre, 10 patients ont été inclus.
Titre de l'essai : essai clinique évaluant l'efficacité du pemigatinib pour le traitement des patients atteints de tumeurs solides présentant une altération du gène FGFR.
Essai coordonné par le Pr Christophe Le TOURNEAU, Institut Curie – Paris
Co-coordonnateur : Pr Nicolas ISAMBERT, CHU de Poitiers – Poitiers
Rationnel de l’essai
Les altérations sur le gène FGFR sont impliquées dans le processus de développement du cancer. On retrouve ces anomalies à des fréquences très variables (de moins de 1% à 10% environ) dans les cancers des voies biliaires, de la vessie, de l’utérus, du cerveau, de l’ovaire, du poumon, des voies aériennes et digestives, du sein, etc.
Le pemigatinib est un médicament anticancéreux agissant sur les cellules avec des altérations du gène FGFR. Il est utilisé en Europe pour traiter les personnes avec un cancer des voies biliaires porteur d’une altération bien précise de FGFR.
Toutefois, dans le cadre de différents essais cliniques, le pemigatinib a montré une activité intéressante chez quelques patients atteints de différents cancers présentant une altération du gène FGFR. Ce traitement pourrait donc être efficace dans plusieurs types de cancers dès lors que l’on détecte une altération de ce gène.
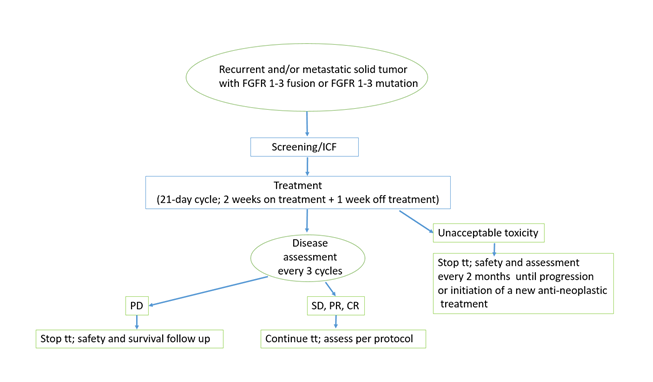
Schéma de l’étude
Objectifs du programme
L’objectif principal est d’évaluer l’efficacité du pemigatinib chez des patients porteurs d'une altération du gène FGFR, quel que soit le type de cancer (à l’exclusion des cancers du sang et ceux déjà traités par le pemigatinib).
Des objectifs secondaires porteront sur l’évaluation de l’efficacité mesurée sous d’autres formes comme le taux de réponse et la durée de la réponse observée sous traitement, l’impact sur le délai de survenue d’une nouvelle progression et la survie globale. L’essai clinique évaluera également la sécurité du pemigatinib et son impact sur la qualité de vie des patients.
Pathologies concernées : tout patient adulte atteint d’un cancer solide récidivant ou métastatique présentant une fusion/remaniement ou une mutation activatrice de FGFR1, 2 ou 3, en dehors des indications approuvées pour tout inhibiteur sélectif de FGFR en France
État d’avancement du programme au 11 décembre 2025
- 19 centres ouverts activés/6 centres actifs/29 centres participants : liste des centres actifs
- 10 patient inclus